خرید اسید کرومیک
فروش اسید کرومیک با تضمین کیفیت و ضمانت بهترین قیمت اسید کرومیک در شرکت پیشگامان شیمی صورت میگیرد. این شرکت وارد کننده اسید کرومیک 98% در گالنهای 50 کیلوگرمی از کشور ترکیه و آفریقا میباشد. این محصول در صنایع آبکاری و لعابکاری کاربردهای فراوانی دارد. در ادامه به بررسی این ماده میپردازیم:
جهت استعلام قیمت اسید کرومیک
و همچنین دریافت مشاوره رایگان با ما تماس بگیرید.
۰۲۱۵۴۰۳۲۳۱۷
۰۲۱۵۴۰۳۲۳۱۸
۰۹۱۲۹۰۰۸۸۶۲
شنبه تا چهارشنبه ۹ الی ۱۷ | پنج شنبه ۹ الی ۱۳
کرومیک اسید چیست؟
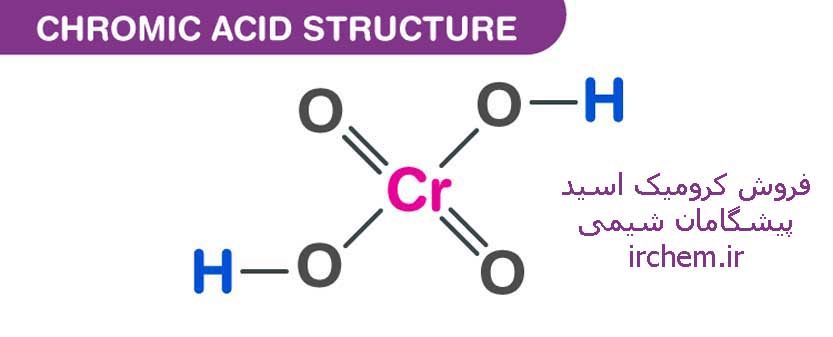
عنوان کرومیک اسید برای تلفیقی از دیکرومات و اسید سولفوریک غلیظ بکار میرود که گاهی ممکن است شامل ترکیباتی دیگر از جمله تریاکسید کروم باشد. به همین دلیل این ماده به عنوان مخلوط شیشه پاککن ممکن است استفاده شود. دیگر کاربرد اسید کرومیک برای اقسام مولکولی، H2CrO4 که تریاکسید آن انیدرید است، استفاده میشود. در کرومیک اسید، کروم در شکل اکسیداسیون 6+ (یا VI) واقع است.
فرمول مولکولی اسید کرومیک، H2CrO4 است که دارای نقاط اشتراکی زیادی با سولفوریک اسید، H2SO4 میباشد. اگرچه فقط پروتون اول را به راحتی از دست میدهند اما هر دو اسید تحت عنوان اسیدهای قوی طبقهبندی میشوند.
+H2CrO4 ⇌ [HCrO4−] + H
خواص اسید کرومیک – H2CrO4
| فرمول شیمیایی | H2CrO4 |
| وزن مولکولی کرومیک اسید | 118.008 g/mol |
| چگالی | 1.201 g/cm3 |
| نقطه ذوب | 197 °C |
| نقطه جوش | 250 °C |
قدرت اسیدی کرومیک اسید:
مقادیر گزارششده برای pKa این تعادل بین 8/0 تا 1.6 متفاوت است و به صورت دقیق مشخص نشده است. تعیین مقدار pKa در قدرت یونی صفر دشوار است زیرا فقط نیمی از تفکیک در محلول بسیار اسیدی، در pH تقریباً 0، یعنی با غلظت اسید در حدود mol dm-3 ١ رخ میدهد. یک مانع دیگر در اندازهگیری pKa این است که یون –[HCrO4] تمایل به تشکیل دیمر دارد و یون دیکرومات، -2[Cr2O7] تشکیل میدهد.
این یک ماده اکسید کننده قوی و خورنده است. علاوه بر این، دیکرومات میتواند دپروتونه شود:
HCr2O7]− ⇌ [Cr2O7]2− + H+ pK = 1.8]
مقدار pK این واکنش نشان میدهد که میتوان آن را در pH> 4 نادیده گرفت. از دست دادن پروتون دوم در محدوده pH 4-8 رخ میدهد و یون –[HCrO4] یک اسید ضعیف میباشد. کرومیک اسید مولکولی را در اصل میتواند با افزودن تریاکسید کروم به آب (مانند تولید سولفوریک اسید) تولید کرد.
CrO3 + H2O ⇌ H2CrO4
وقتی کرومیک اسید مولکولی کم آب شود واکنش معکوس رخ میدهد. این همان چیزی است که وقتی سولفوریک اسید غلیظ به محلول دیکرومات اضافه میشود، اتفاق میافتد. در ابتدا رنگ از نارنجی (دیکرومات) به قرمز (اسیدکرومیک) و سپس کریستالهای تریاکسید کروم به رنگ قرمز تند، بدون تغییر رنگ بیشتر رسوب میکنند. این تغییر رنگها به دلیل انتقال LMCT است.
تری اکسید کروم، انیدرید کرومیک اسید مولکولی است که یک اسید لوئیس است و میتواند با یک باز لوئیس مانند پیریدین در یک محیط غیر آبی مانند متیلن کلراید (معرف کالنز) واکنش نشان دهد.

طرز تهیه اسید کرومیک
روش ساخت اسید کرومیک به این شکل است که ابتدا دی کرومات سدیم یا دی کرومات پتاسیم باید با کمی آب ترکیب میشود تا خمیر تولید شود. هنگام اضافه کردن اسید سولفوریک به خمیر به صورت مداوم آن را مخلوط میکنند تا کرومیک اسید تشکیل میشود.
کاربرد کرومیک اسید:
این یک ماده حد واسط در آبکاری کروم است و در لعابهای سرامیکی و شیشههای رنگی نیز کاربرد دارد. از آنجا که یک محلول اسید کرومیک در اسید سولفوریک (که به عنوان مخلوط سولفوکرومیک یا اسید کروموسولفوریک نیز شناخته میشود) یک ماده اکسید کننده قوی است، میتوان از آن برای تمیز کردن شیشههای آزمایشگاهی، به خصوص باقیماندههای آلی غیر محلول استفاده کرد. البته این کاربرد به دلیل نگرانیهای زیستمحیطی کاهش یافته است.
علاوه بر این، از خاصیت پارامغناطیسی یونهای کرومیک میتوان در برنامههای خاص مانند طیفسنجی NMR استفاده کرد که این کاربرد به ویژه در مورد لولههای NMR قابل استفاده است. این ماده به دلیل توانایی آن در “براق کردن” برنج خام، در صنعت تعمیر ابزار مورد استفاده قرار میگیرد و میتواند زنگار روی برنج را ازبین میبرد. در دهه 1940 از این اسید در رنگ موها با نام ملیرون استفاده میشد. از کرومیک اسید آفریقایی به عنوان سفید کننده در پردازش معکوس عکاسی سیاه و سفید استفاده میشود.
فرم کاملاً پروتون شده یون دی کرومات، اسید دی کرومیک، H2Cr2O7 است و میتواند به عنوان نتیجه افزودن تری اکسید کروم به اسید کرومیک مولکولی دیده شود. هنگام واکنش با آلدئید یا کتون، اسید دی کرومیک میتواند دقیقا همان رفتار را داشته باشد. با این حال، بیش از یک کتون را اکسید نمیکند و کتون نوع دوم و اسید دی کرومیک فقط آلدئید را اکسید میکند. برای اولین مرحله از مکانیسم، آلدهید به یک کتون اکسید میشود و دوباره به یک اسید کربوکسیلیک اکسید میشود، بدون این که مانع عمدهای از اثرات فضایی ایجاد کند و مانع این واکنش شود.
اسید کرومیک قادر به اکسیداسیون انواع مختلف ترکیبات آلی است و انواع مختلفی برای این معرف ایجاد شده است. از کرومیک اسید به عنوان معرف جونز در اسید سولفوریک آبی و استون یاد میشود که الکلهای اولیه و ثانویه را به ترتیب به اسیدهای کربوکسیلیک و کتون اکسید میکند، هرچند بندرت پیوندهای اشباع نشده را تحت تأثیر قرار میدهد. تری اکسید کروم و پیریدینیم کلرید، پیرویدینیم کلروکرومات را تولید میکند. این معرف به آلدئیدهای متناظر(R-CHO) الکلهای اولیه تبدیل میشود.
کدام مواد برای خنثی سازی کرومیک اسید ایده آل هستند؟
کرومیک اسید صنعتی ابتدا باید در مقدار کافی آب رقیق شود. سپس، میتوان آن را پس از فرآیند رقیق سازی با یک احیا کننده خنثی کرد. برخی از عوامل خنثی کننده عالی متابی سولفیت سدیم/پتاسیم، تیو سولفات سدیم یا سولفیت سدیم هستند.
ایمنی کرومیک اسید:
ترکیبات کروم ششضلعی از جمله:
- تریاکسید کروم
- اسید کرومیکها
- کرومات
- کلروکروماتها
سمی و سرطانزا هستند. به همین دلیل، از اکسیداسیون اسید کرومیک در مقیاس صنعتی به جز در صنعت هوافضا استفاده نمیشود. تریاکسید کروم و کرومیک اسیدها، اکسید کنندههای قویی هستند و در صورت مخلوط شدن با مواد آلی که به راحتی اکسیده میشوند ممکن است واکنش شدیدی نشان دهند. ممکن است آتشسوزی یا انفجار رخ دهد. سوختگیهای ناشی از تماس با کرومیک اسید با محلول رقیق سدیم تیوسولفات درمان میشوند.
اثرات جانبی کرومیک اسید
کارخانه آبکاری کروم که دارای تهویه ضعیف است، منجر به غلظت بیش از حد گازهای تری اکسید کروم میشود، کارگران هنگام کار روی مخازن کرومات علائم سرگیجه، سردرد و ضعف را تجربه میکنند.
اثر کرومیک اسید بر پوست
اثبات شده است که قرار گرفتن پوست در معرض کروم باعث ایجاد درماتیت تماسی تحریک کننده و آلرژیک میشود. درماتیت تحریککننده اولیه مربوط به خصوصیات سیتوتوکسیک مستقیم کروم است، در حالی که درماتیت تماسی آلرژیک یک واکنش التهابی است که به واسطه سیستم ایمنی بدن انجام میشود.
درماتیت تماسی آلرژیک یک پاسخ ایمنی با واسطه سلول است که در یک فرآیند دو مرحلهای اتفاق میافتد. در مرحله اول (القا)، کروم به پوست جذب میشود و مرحله بعدی را تحریک میکند، یک پاسخ ایمنی (حساس سازی). افراد حساس هنگامی که در معرض کروم بالاتر از حد آستانه باشند، درماتیت آلرژیک نشان میدهند.
درماتیت آلرژیک به کروم با علائم زیر مشخص میشود:
- خشکی
- اریتم
- شکاف زدن
- پاپول (سفت دانه)
- مقیاس گذاری
- تاولهای کوچک
- تورم
به نظر میرسد حلالیت و pH از عوامل اصلی تعیینکننده ترکیبات جداگانه کروم برای ایجاد پاسخ آلرژیک است. ترکیبات با حلالیت پایین Cr (III) نسبت به Cr (VI) آلرژنهای تماسی بسیار کارآمدتری هستند.
نفوذ پوست با تأخیر در بهبود باعث زخم فرسایشی بدون درد (“سوراخهای کروم”) میشود. این موارد معمولاً در انگشتان و بازوها اتفاق میافتد. زخم مشخصه کروم به صورت پاپول شروع میشود و زخمی با لبههای سخت برآمده تشکیل میدهد. زخمها میتوانند به عمق بافت نرم نفوذ کنند یا به محل عفونت ثانویه تبدیل شوند، اما شناخته شده نیستند که منجر به بدخیمی شوند. کار با ترکیبات Cr (VI)، اثراتی بر روی پوست، تیغه بینی و لاله گوش همراه داشته است.
کروم یکی از رایج ترین مواد حساسیتزا برای پوست است و اغلب باعث ایجاد اثر حساسیت در پوست در عموم مردم میشود. منبع احتمالی قرار گرفتن در معرض کروم، دفع زباله برای فرایند آبکاری تولید کننده کرومات است که باعث آلودگی هوا یا آب محلی میشود.

اثر کرومیک اسید بر کلیه
اثرات کلیوی پس از استنشاق یا قرار گرفتن در معرض خوراکی ترکیبات (Cr (VI گزارش شده است. مسمومیت شدید میتواند منجر به نکروز حاد لولهای و نارسایی حاد کلیه شود. قرار گرفتن در معرض (Cr (VI با دوز کم معمولاً منجر به اثرات کلیوی گذرا میشود. افزایش سطح β2-میکروگلوبولین در ادرار (شاخص آسیب لوله کلیوی) در پلاسترهای کروم یافت شده است و سطح بالاتری در افراد جوانی که در معرض غلظتهای بالاتر (Cr (VI هستند مشاهده شده است.
جهت دریافت Msds اسید کرومیک صنعتی با ما تماس بگیرید.
از روشهای ایمونوشیمیایی حساس برای اندازهگیری پروتئینهای خاص در ادرار برای تشخیص زودرس آسیب کلیه استفاده شده است و آستانه احتمالی در سطح قرار گرفتن در معرض 15 میکروگرم بر گرم کراتینین در ادرار نشان داده شده است. به نظر نمیرسد مواجهه شغلی با (Cr (III با اثرات کلیوی همراه باشد. هیچ اختلال کلیوی بر اساس آلبومین ادرار، پروتئین متصل به رتینول و آنتیژنهای توبولار کلیه در 236 کارگر شاغل در صنعت تولید فروکروم یافت نشد.
تولیدکنندگان اسید کرومیک صنعتی
اصلی ترین تولیدکنندگان و صادرکنندگان این محصول در حال حاضر شرکت های زیر هستند:
- شرکت صنایع آسیایی. MUMBAI- ، هند. …
- بازرگانان مهتا. MUMBAI- ، هند. …
- R.G.ENTERPRISES. حیدرآباد ، هند. …
- صنعت شیمی راکشا. بنگلور ، هند. …
- مواد شیمیایی THANE- ، هند. …
- SUPARSHWA CHEMICAL. …
- LORDS CHEMICALS LTD.
Ph اسید کرومیک
اسید کرومیک (CrO3) یک اسید قوی و اکسیدان است که در محلول آبی تبدیل به یونهای کرومات (CrO4^2-) و هیدروژن میشود. به طور کلی، اسید کرومیک به عنوان یک اسید قوی، مقدار pH بسیار پایینی دارد. اگرچه مقدار دقیق pH بستگی به غلظت محلول دارد، اما معمولاً میتوان انتظار داشت که pH محلول اسید کرومیک در حدود 1 یا کمتر باشد. با توجه به خطرات جدی مرتبط با استفاده از این ترکیب شیمیایی، ایمنی و مراقبتهای لازم برای کار با اسید کرومیک باید به دقت رعایت شود.
فروش اسید کرومیک ترکیه
شرکت بازرگانی پیشگامان شیمی آمادگی دارد ضمن دریافت سفارش شما مشتریان عزیز، کرومیک اسید مورد نیاز صنایع مختلف را با بهترین قیمت اسید کرومیک ترک و بهترین کیفیت تأمین کند. این محصول در سریعترین زمان ممکن به وسیله سیستم حملونقل مطمئن به شهرهای مختلف ارسال میشود. قیمتهای عرضه شده توسط این شرکت همواره پائینترین قیمت است و شما مشتریان عزیز میتوانید ضمن استعلام قیمت، با قیمت سایر اشخاص حقیقی و حقوقی دیگر مقایسه نمائید.
قیمت کرومیک اسید
پیشگامان شیمی به عنوان یکی از وارد کنندگان اسید کرومیک چینی و ترک در ایران، مفتخر است که با ارائه کیفیت بالا و قیمت مناسب به نیاز مشتریان عزیز در صنعت پاسخگو باشد. اسید کرومیک، یک ترکیب شیمیایی با فرمول CrO3 است که به عنوان یک عامل اکسید کننده قوی در مواد پلاستیکی، الکتروپلاکینگ، تولید پوششهای ضد زنگ و سایر صنایع کاربرد دارد. قیمت اسید کرومیک ترک ممکن است بر اساس تغییرات بازار، نوسانات ارزی و تامین مواد اولیه متفاوت باشد. برای کسب اطلاعات بیشتر در مورد قیمت روز و شرایط خرید، لطفاً با ما در ارتباط باشید.
طرحواره پیدا نشد.

