پیشینه ساخت باتری
آزمایش معروف بنجامین فرانکلین برای جذب الکتریسیته با پرواز بادبادک در طوفان صاعقهای تنها یکی از آزمایشهای اواخر قرن هجدهم و اوایل قرن نوزدهم بود که برای یادگیری در مورد برق انجام شد. اولین باتری در سال 1800 توسط الساندرو ولتا ایتالیایی ساخته شد.
به اصطلاح شمع ولتایی شامل دیسکهای متناوب نقره و روی بود که توسط چرم یا مقوا از هم جدا شده بودند که در آب نمک، لیزر یا مقداری محلول قلیایی آغشته شده بودند. نوارهای فلزی در هر انتهای شمع به فنجانهای کوچک پر از جیوه متصل میشدند. وقتی ولتا با انگشتان خود هر دو فنجان جیوه را لمس کرد، دچار برق گرفتگی شد. هرچه تعداد دیسکهای او بیشتر شود، لرزش بیشتری دریافت میکند.
کشف ولتا منجر به آزمایشهای بیشتر شد. در سال 1813، سر همفری دیوی در زیرزمین موسسه سلطنتی لندن شمعی را با 2000 جفت دیسک ساخت. در میان سایر کاربردها، دیوی از الکتریکی که برای الکترولیز تولید کرده استفاده کرد. (کاتالیز واکنشهای شیمیایی با عبور جریان از مواد که دیوی سدیم و پتاسیم را از ترکیبات جدا کرد).
تنها چند سال بعد، مایکل فارادی اصل القای الکترومغناطیسی را کشف کرد و از آهنربا برای القای برق در سیم پیچ خورده استفاده کرد. این روش در قلب پویایی است که امروزه برای تولید برق در نیروگاهها استفاده میشود. (در حالی که یک دینام جریان متناوب (AC) تولید میکند که در آن جریان برق به طور منظم جهت را تغییر میدهد، باتـریها جریان مستقیم (DC) را تولید میکنند که فقط در یک جهت جریان مییابد.) یک سلول اسید سرب که قادر به تولید مقدار بسیار زیادی جریان است، پیشگام باتری اتومبیل امروز، در سال 1859 ابداع شد.

در ایالات متحده، توماس ادیسون در حال آزمایش برق از دو باتری و دینام برای تأمین لامپ بود که از اوایل دهه 1880 در ایالات متحده شروع به پخش کرد. در طول دهه 1860، ژرژ لكلانشه سلول مرطوب را اختراع كرد، گرچه به دلیل اجزای مایع سنگین بود، اما میتوانست به صورت تجاری فروخته شود و مورد استفاده قرار گیرد.
در دهه های 1870 و 1880، سلول لكلانشه با استفاده از مواد خشک تولید میشد و برای تعدادی از کارها، از جمله تأمین برق برای تلفن الکساندر گراهام بل و چراغ قوه تازه اختراع شده، مورد استفاده قرار گرفت. متعاقباً تصمیم گرفتند که از باتریها برای بسیاری از اختراعات دیگر مانند رادیو که در سالهای پس از جنگ جهانی اول بسیار محبوب شد، تأمین برق کنند. امروزه سالانه بیش از بیست میلیارد سلول برق در سراسر جهان فروخته میشود.
طراحی باتری
همه باتـریها از روشهای مشابهی برای ایجاد برق استفاده میکنند. با این حال، تغییرات در مواد و ساخت و ساز انواع مختلفی از باتری را تولید کرده است. به عبارت دقیق، آنچه معمولاً باتری نامیده میشود در واقع گروهی از سلولهای متصل است. در زیر شرح سادهای از نحوه کار باتـری آورده شده است.
دو قسمت مهم هر سلول آند و کاتد است. کاتد فلزی است که به طور طبیعی یا در آزمایشگاه با اکسیژن ترکیب میشود – به این ترکیب اکسید گفته میشود. اکسید آهن (زنگ زدگی) اگرچه برای استفاده در باتری بسیار شکننده است، اما شاید آشنا ترین اکسید باشد.
برخی اکسیدهای دیگر در واقع به اندازه کافی قوی هستند که میتوانند کار شوند (برش خورده، خم شوند، شکل بگیرند، قالب بزنند و غیره) و در سلول استفاده شوند. آند فلزی است که در صورت اجازه اکسید میشود و در صورت مساوی بودن، بیشتر از فلزی که بخشی از کاتد را تشکیل میدهد، اکسید میشود.
هنگامی که یک انتهای کاتد و یک انتهای آند در ماده سوم قرار میگیرند که میتواند الکتریسیته را هدایت کند، سلول تولید برق میکند، در حالی که انتهای دیگر آنها متصل است. آند اتمهای اکسیژن را به سمت خود میکشد و در نتیجه جریان الکتریکی ایجاد میکند. اگر در مدار سوئیچ وجود دارد (شبیه هر کلید دیواری یا لامپ)، مدار کامل نیست و نمیتواند جریان برق داشته باشد مگر اینکه کلید در وضعیت بسته باشد.
اگر علاوه بر سوئیچ، چیز دیگری مانند لامپ در مدار وجود داشته باشد، لامپ از اصطکاک الکترونهایی که در آن حرکت میکنند، روشن میشود.
سومین مادهای که آند و کاتد در آن قرار میگیرد الکترولیت نامیده میشود. در بسیاری از موارد این ماده یک ترکیب شیمیایی است که خاصیت قلیایی بودن دارد. بنابراین، باتری قلیایی، باتری است که از الکترولیت قلیایی استفاده میکند. سلول به خودی خود برق تولید نمیکند مگر اینکه در مداری قرار گیرد که با یک سوئیچ ساده یا با اتصال سوئیچ دیگری در دستگاه با استفاده از باتری کامل شده باشد.
طراحی یک سلول میتواند منجر به تغییرات زیادی در نوع و ساختار شود. به عنوان مثال همه الکترولیتها قلیایی نیستند.
علاوه بر این، ظرف برای الکترولیت میتواند هم به عنوان یک ظرف و هم به عنوان کاتد یا آند عمل کند. برخی از سلولها اکسیژن خود را نه از طریق کاتد بلکه از هوا خارج میکنند. تغییر در ترکیبات آند و کاتد برق کم و بیش را تأمین میکند. تنظیم دقیق کلیه مواد به کار رفته در سلول میتواند بر میزان الکتریسیته تولیدی، میزان تولید، ولتاژ تحویل الکتریسیته در طول عمر سلول و توانایی سلول در دمای مختلف تأثیر بگذارد. .
در واقع همه این احتمالات وجود دارد و کاربردهای گوناگون آنها انواع مختلفی از باتریهای امروزی (لیتیوم، جیوه و غیره) را تولید کرده است. سالهاست که متداولترین سلول باتری قلیایی 1.5 ولتی است. باتریهای مختلف در شرایط مختلف عملکرد بهتری دارند. سلول قلیایی 1.5 ولتی برای تجهیزات عکاسی، کامپیوترهای دستی و ماشین حسابها، اسباب بازیها، ضبط صوت و سایر موارد “تخلیه زیاد” ایده آل است.
در دمای پایین نیز خوب است. این سلول دارای ویژگی تخلیه شیب دار است. به جای اینکه به طور ناگهانی تولید برق را متوقف کند، به تدریج نیرو را از دست میدهد و در صورت عدم استفاده در قفسه، ممکن است سالانه چهار درصد از انرژی خود را از دست بدهد.
انواع دیگر باتریها شامل یک باتری لیتیوم/دی اکسید منگنز است که دارای یک ویژگی تخلیه مسطح است. در ابتدای عمر خود تقریباً همان میزان انرژی را تأمین میکند که در انتها وجود دارد و میتواند در مواردی که نیاز به باتریهای کوچک و کم مصرف باشد، مورد استفاده قرار گیرد. (آلارم دود، دوربین، پشتیبان گیری حافظه در رایانه ها و غیره).

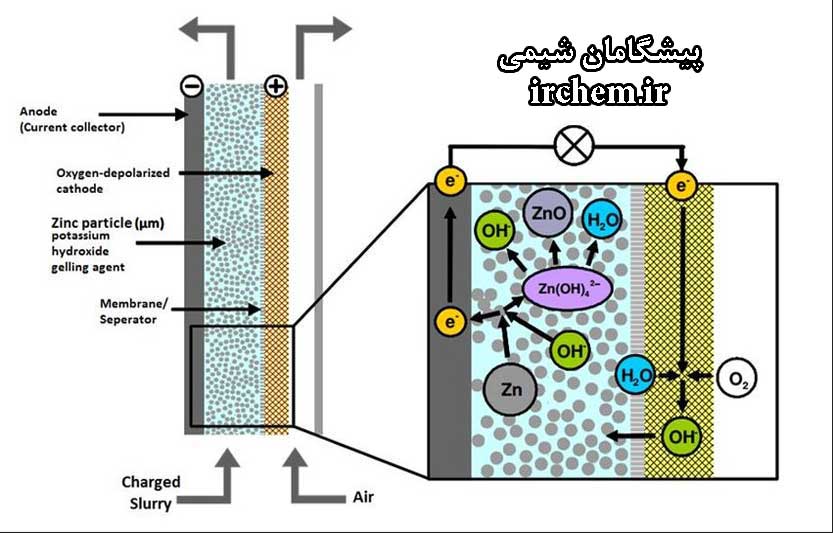
باتریهای دپولاریزه هوا
یک روش بسیار عملی برای به دست آوردن چگالی انرژی بالا در باتری، استفاده از اکسیژن موجود در هوا برای یک ماده کاتدی “مایع” است. در صورت جفت شدن با آند مانند روی، میتوان عمر طولانی سلول را با هزینه کم در هر وات ساعت (برای یک سلول خشک) بدست آورد، زیرا ممکن است حجم باتری مشخصی به آند و مواد الکترولیت اختصاص یابد. باتری باید به گونهای ساخته شود که از رسیدن اکسیژن به آند جلوگیری شود، خصوصاً در زمان ذخیره سازی.
سیستمهای روی روی هوا به صورت تجاری از سلولهای بسیار کوچک مانند باتریهای سمعک گرفته تا باتریهای نسبتاً بزرگ جعبه مانند در دسترس هستند. اصل و طراحی آنها ساده است، اما تولید باتریهای واقعی از نظر فنی دشوار است. “الکترود هوا” بسیار نازک است و معمولاً دارای یک لایه کربن متخلخل متصل به پلیمر ضد آب با تقویت کننده مش فلزی است. یک کاتالیزور و یک اکسید تقویت کننده ممکن است همراه کربن باشند تا اکسیژن را به طور موثرتری فعال کنند. آببندی لبههای فیلم الکترود کامپوزیت و ضد الکترولیت منافذ با استفاده از فلوروکربنها و پلاستیکها حاصل شده است.
پیشرفتهای اساسی در مونتاژ الکترود، مهر و موم سلول و طرحهای دریچه همچنان در مطالعات علمی و مهندسی جستجو میشود. باتریهای آلومینیوم و هوا تاکنون موفقیت عمده تجاری نداشتهاند، اما وزن سبک و چگالی انرژی بالقوه آنها حمایت دولتی زیادی را در ایالات متحده جلب کرده است. تلاشهای تحقیقاتی در زمینه تولید آلیاژها و تکنیکهای بهتر آلومینیوم برای مقاومت در برابر خوردگی در هنگام ذخیره سازی قفسه فروشگاه ها متمرکز شده است.
به طور مشابه، بازدارندههایی برای گنجاندن در الکترولیت قلیایی تحت مطالعه هستند. باتریهای آلومینیوم و هوا همچنین برای کاربردهایی در نظر گرفته شدهاند که در آن آند فلزی، الکترولیت و محصولات واکنش به صورت مکانیکی برداشته شده و جایگزین میشوند تا نوعی سلول سوختی ایجاد شود.
اگر مشکلات ثبات و طراحی برطرف شود، ممکن است این سیستم برای بسیاری از کاربردها، از جمله استفاده در اتومبیلهای برقی یا کامیونها جذاب باشد.

مواد اولیه مورد استفاده در باتری
این بخش، و همچنین بخش زیر، روی باتریهای قلیایی تمرکز خواهد کرد. در یک باتری قلیایی، سیلندر حاوی سلولها از فولاد نیکل اندود شده ساخته شده است. این یک جدا کننده است که کاتد را از آند جدا میکند و از کاغذ لایهای یا یک ماده مصنوعی متخلخل ساخته شده است.
قوطی در یک انتهای خود با یک درزگیر آسفالت یا اپوکسی که زیر یک صفحه فولادی قرار دارد مهر و موم شده و در قسمت دیگر با میخ برنجی که از طریق استوانه عبور میکند، مهر و موم میشود. این میخ به یک درپوش انتهایی فلزی جوش داده می شود و از یک مهر و موم پلاستیکی خارجی عبور میکند. در داخل استوانه، کاتد از مخلوطی از دی اکسید منگنز، گرافیت و یک محلول هیدروکسید پتاسیم تشکیل شده است. آند شامل پودر روی و یک الکترولیت هیدروکسید پتاسیم است.
مسائل زیست محیطی در مورد باتری
اگرچه ساخت باتری برخی از موانع زیست محیطی را به همراه دارد، اما هیچ یک از اینها غیرقابل عبور نیستند. روی و منگنز، عمده مواد شیمیایی موجود در باتریهای قلیایی، مشکلات زیست محیطی ایجاد نمیکنند،و هر دو توسط سازمان غذا و دارو (FDA) بیخطر تلقی میشوند. مهمترین آلاینده احتمالی در باتریها جیوه است که معمولاً روی را همراهی میکند و سالها برای کمک به رسانایی و جلوگیری از خوردگی به باتریهای قلیایی اضافه میشد. در اواسط دهه 1980، باتریهای قلیایی معمولاً بین پنج تا هفت درصد جیوه داشتند.
هنگامی که چندین سال پیش مشخص شد که جیوه یک خطر زیست محیطی است، تولید کنندگان شروع به جستجوی راههایی برای تولید باتریهای کارآمد بدون آن کردند. روش اصلی انجام این کار بر کنترل بهتر خلوص مواد تشکیلدهنده است. باتریهای قلیایی امروز ممکن است تقریباً 025/0 درصد جیوه داشته باشند. باتریهایی که فاقد هرگونه جیوه اضافه شدهاند، از برخی تولیدکنندگان در دسترس است.



1 دیدگاه. ارسال دیدگاه جدید
شما کانال تلگرام هم دارین؟